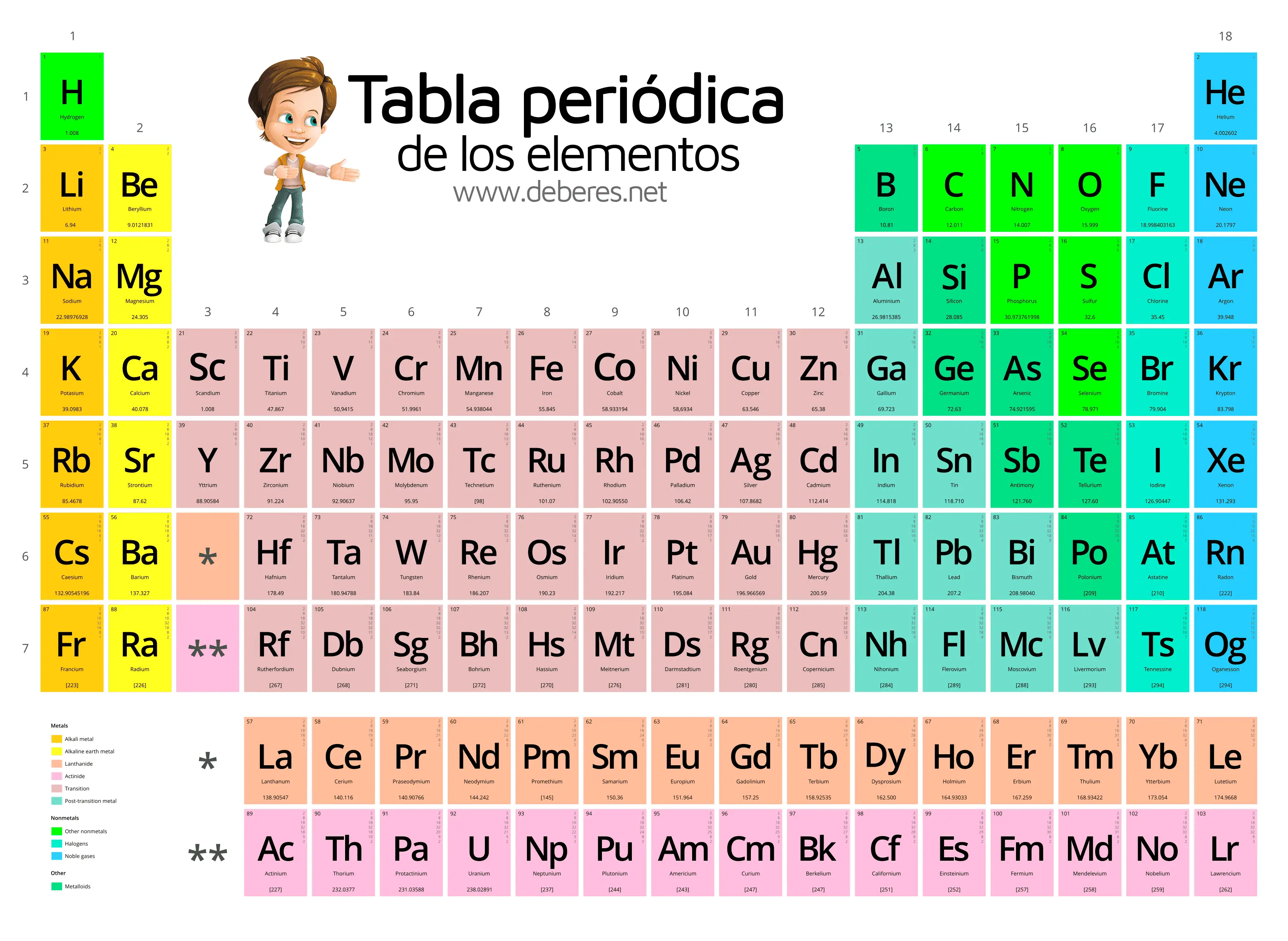
TABLA PERIODICA: FILA 4
METALES DE TRANSICIÓN, LANTANIDOS Y ACTÍNIDOS
METALES DE TRANSICIÓN:
¿Qué son los metales de transición?
Se define como metales de transición a aquellos elementos que están situados en la parte central del sistema periódico, en el bloque d. Se caracteriza principalmente por incluir su configuración electrónica en el orbital d, parcialmente lleno de electrones. También, se define como aquellos metales cuyo átomo posee una subcapa incompleta, que puede llegar a generar cationes con la misma particularidad.Cabe destacar que este grupo está formado por 40 elementos químicos que van del 21 al 30, del 39 al 48, del 71 al 80 y del 103 al 112. Se les conoce como metales de transición por su estabilidad, ya que no poseen la necesidad de reaccionar con otro elemento. En otras palabras, cuando le falta un electrón a la capa externa para estar completa, este los toma de una capa interna y así sucesivamente. A este fenómeno se le conoce como transición electrónica.
CARACTERISTICAS:
- Casi todos los elementos de transición son metales típicos: tienen altos puntos de ebullición y fusión, gran dureza, conducen bien la electricidad y el calor. La mayoría de las propiedades de estos elementos se deben a que sus electrones del orbital D se localizan en la red metálica.
- Las combinaciones son fuertemente paramagnéticas y coloreadas.
- Generalmente son buenos catalizadores.
- Pueden crear aleaciones entre sí mismos.
- Crean complejos iónicos.
- A excepción del mercurio, se encuentran en estado sólido a temperatura ambiente.
ELEMENTOS QUE LOS CONFORMA:
LANTANIDOS:
Los integrantes de este grupo son los elementos: lantano (La), cerio (Ce), praseodimio (Pr), neodimio (Nd), prometio (Pm), samario (Sm), europio (Eu), gadolinio (Gd), terbio (Tb), disprosio (Dy), holmio (Ho), erbio (Er), tulio (Tm), iterbio (Yb), lutecio (Lu), escandio (Sc) y el itrio (Y). Todos tienen electrones en los orbitales f de la capa 4, y es precisamente esta particularidad, lo que los define como tierras raras.
CARACTERISTICAS:
En primer lugar, es importante destacar que estos son elementos que tienen gran parecido entre sí, debido a los enlaces que forman y por tener un estado de oxidación +3. Además, abundan en la corteza terrestre, siendo la monacita un ejemplo de ello. Otros aspectos destacados son:
- Se encuentran ubicados en la parte inferior de la tabla periódica de los elementos junto con los actínidos. Abarcan el periodo 6 del sistema periódico.
- La mayoría comparte la estructura química del lantano, el cual es menos reactivo químicamente y pertenece al nivel energético f.
- A medida que su número atómico aumenta, el radio disminuye. Aunque no son variaciones grandes, esta se va acumulando provocando que los elementos del grupo d presenten radio similares. Esto se conoce como contracción de los lantánidos.
- Se le denomina tierras debido a que en la antigüedad se les llamaba así a los óxidos, por su carácter insoluble, apariencia amorfa y por no cambiar de estado físico con el calor.
- El término “rara” se debe a la baja concentración en los materiales de donde se purificaban.
- No son elementos con gran toxicidad, por lo que la ingestión accidental no genera consecuencias letales al organismo.
Por otra parte, es importante mencionar que no se encuentran en estado libre en la naturaleza, sino como elementos como la allanita, loparita, parisita, entre otros. Todos tienen un aspecto metálico y brillante.
ACTINIDOS:
Los actínidos consisten en una familia de 15 elementos que varían en números atómicos del 89 al 103. Piense en el número atómico como una forma de identificar un elemento en una tabla periódica. Los 15 elementos incluyen: Actinio (Ac), Torio (Th), Protactinio (Pa), Uranio (U), Neptunio (Np), Plutonio (Pu), Americio (Am), Curio (Cm), Berkelio (Bk), Californio (Cf), Einstenio (Es), Fermio (Fm), Mendelevio (Md), Nobelio (No) y Lawrencio (Lr).
Hasta aproximadamente 1940, los científicos pensaban que el átomo más pesado era el uranio, que fue el primer actínido descubierto a fines del siglo XVIII. Los avances en la ciencia llevaron a futuros descubrimientos de numerosos elementos que ahora llamamos colectivamente actínidos. Muchos de los elementos actínidos se encontraron o crearon entre 1955 y 1961.
Algunos actínidos se encuentran en la naturaleza, mientras que otros son artificiales. Los científicos han podido encontrar cinco elementos de la familia de los actínidos en la naturaleza: torio, protactinio, uranio, neptunio y plutonio. Se descubrieron varios actínidos mientras se realizaban experimentos científicos; fueron hechos artificialmente de uranio, llamados elementos transuránicos y en su mayoría tienen una vida corta.
CARACTERISTICAS:
- Se encuentran ubicados en el periodo 7 de la tabla periódica.
- Conforman un total de 15 elementos.
- Tienen la misma estructura que posee el actino y por ello derivan su nombre.
- Los electrones que aumentan en cada elemento lo hacen en el nivel 5f, haciéndolos menos reactivos.
- En estado natural siempre forman oxidos.
- Tienen valencias variables, pero en su mayoría tienen valencias +3 y +4.
AHORA VOY HABLAR DE LOS ELEMENTOS QUIMICOS QUE PERTENECEN A LA FILA 4D, CUALES SON:
A pesar de ello, no fue hasta que la industria aerodinámica descubrió las enormes propiedades del titanio, cuando comenzó a revalorizarse y a ser utilizado para de forma común.
El zirconio tiene una covalencia normal de 4, y exhibe casi siempre covalencias coordinadas de 5, 6, 7 y 8. El zirconio posee un estado de oxidación 4 en casi todos sus compuestos.
HAFNIO: Elemento metálico, símbolo Hf, número atómico 72 y peso atómico 178.49. Hay cinco isótopos naturales. Es uno de los elementos menos abundantes en la corteza terrestre.
El hafnio es un metal plateado, lustroso, que se funde cerca de los 2222ºC (4032ºF). El metal no tiene aplicaciones excepto en barras de control para reactores nucleares.
En el laboratorio de Radiación Lawrence de la Universidad de California, en Berkeley, A. Ghiorso y colaboradores intentaron obtener confirmación adicional del descubrimiento de Dubna. Por 1969 el grupo de Berkeley tuvo, sin duda alguna, éxito en el descubrimiento incuestionable de dos isótopos emisores alfa del elemento 104 con número de masa 257 y 259, al bombardear 249Cf con proyectiles de 12C y 13C en el acelerador lineal de iones pesados de Berkeley (HILAC). Dado que el grupo de Berkeley concluyó que el descubrimiento del grupo de Dubna no fue válido, sugirió que el elemento 104 se nombrara Rutherfordio, con el símbolo Rf, en honor de Lord Rutherford.
LANTANO:El lantano es el elemento químico que da origen a la serie química de los lantánidos. En la tabla periódica se halla entre el bario y el cerio. Posee una masa atómica igual a 138,906, se representa por el símbolo La y su número atómico es el 57.
El lantano es un metal relativamente abundante en la corteza terrestre que se encuentra generalmente junto con el cerio, y otros elementos, en minerales de tierras raras, como la monacita y la bastnasita.
Este metal lantanoide fue descubierto en 1839 por el químico sueco Carl Mosander como una impureza en una muestra de nitrato de cerio, que obtuvo tostando la muestra y diluyéndola luego en ácido nítrico, para así obtener óxido de lantano.




.jpg&ehk=xxguqzVgU%2b7cOh5Ethc73GJFQ%2fpStwvMmI1uqRmtmQQ%3d&risl=&pid=ImgRaw&r=0&sres=1&sresct=1)
Comentarios
Publicar un comentario